检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
作为生命活动的直接执行者,蛋白质功能的实现常依赖于其结构的动态性与稳定性之间的微妙平衡。主要由FtsZ蛋白所形成的细菌细胞分裂环(也被称为“Z环”)完美地体现了这种平衡过程:这种蛋白质既需在细胞中部形成稳定的环状结构以招募多种其它蛋白质而形成分裂体,同时又需不断地动态重构以驱动细胞一分为二。尽管FtsZ蛋白已被研究三十余年,但分裂环是如何从其动态组装/去组装的过程中显现的呢?仍缺少答案。
2025年6月4日,北京大学生命科学学院昌增益课题组在Nature Communications发表题为“A FtsZ cis disassembly element acts in Z-ring assembly during bacterial cell division”的研究论文,首次揭示FtsZ蛋白N末端的一段无序结构发挥了内源性(顺式)去组装元件的功能。它通过一种“自我刹车”机制调控着细胞分裂环的动态组装过程以及在细胞内的空间定位;这为理解细菌分裂环的时空精密调控提供了关键知识。
该研究团队通过多种前沿技术的联用成功捕捉到活细胞内分裂环处于不同阶段的“分子快照”。这包括利用通过遗传学方法引入到FtsZ蛋白中的非天然氨基酸在活细胞内进行光交联,以捕获FtsZ蛋白的瞬时相互作用;通过自主研发的高通量蛋白质电泳技术(单块凝胶可同步分析384种蛋白质样品)实现超灵敏的蛋白质互作图谱分析;通过高分辨率质谱技术解析N末端无序区域(N-terminal intrinsically disordered region,N-IDR)的精确互作网络等等,因此而系统地解析了FtsZ蛋白在活细胞中的动态组装模式。
该团队的研究揭示,FtsZ蛋白的N末端无序区域通过竞争性结合至FtsZ蛋白组装形成的原丝纤维的纵向互作表面而减弱其相互作用,从而发挥内源性(顺式)的去组装功能。在此基础上,外源性的(反式)蛋白质因子(如MinC蛋白等)通过其所形成的浓度梯度而确保分裂环精准定位于细胞的中部。这表明,FtsZ蛋白本身结构所促进的组装和去组装的对抗性平衡是细胞分裂环形成和发挥功能的核心内容。
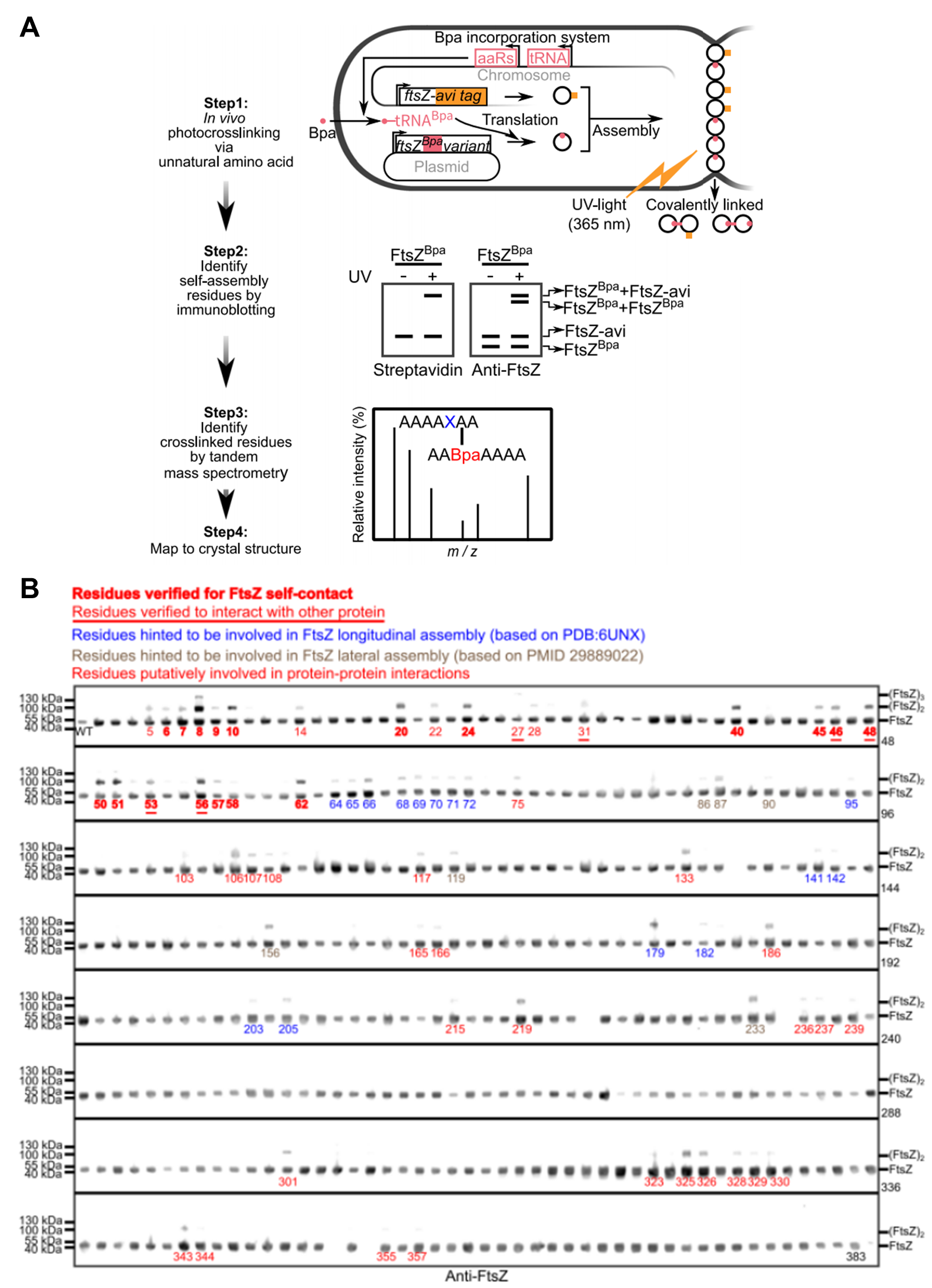
图1 鉴定活细胞内FtsZ蛋白中的各氨基酸残基介是否介导自组装的流程图(A)及高通量检测FtsZ蛋白全部氨基酸位点是否介导自组装的结果图(B)
传统研究主要聚焦于细胞分裂环中蛋白质的组装机制,而对组装后的去组装过程如何发生知之甚少。该研究成果不仅解答了细菌分裂过程本身的科学问题,同时还开创性地揭示了蛋白质分子中的无序结构元件介导蛋白质动态组装和去组装的新范式。事实上,蛋白质的这种动态组装和去组装过程普遍存在于不同生命活动中。该研究发现的内源性(顺式)去组装元件是否也参与其他生物过程中的蛋白质动态调控,是一个值得深入探索的重要科学问题。
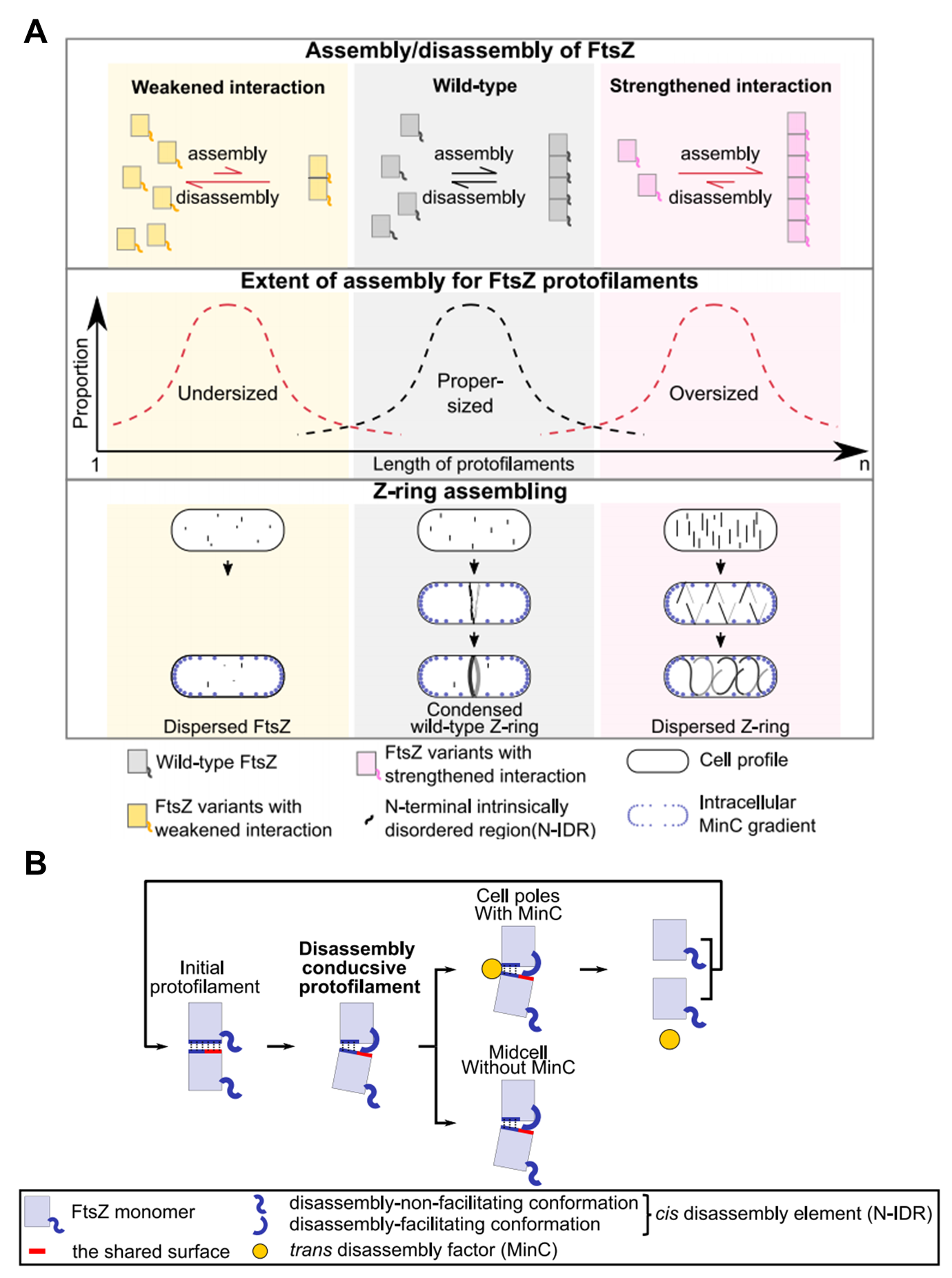
图2 细菌细胞分裂环的形成(A)及内源性(顺式)元件促进FtsZ蛋白组成形成的原丝纤维在细胞中部组装的分子机制示意图(B)
北京大学生命科学学院已毕业的殷会佳博士为该文的第一作者,实验室的刘洋老师和2023级研究生赵莹同学为本文的并列第一作者。已毕业的2018级本科生陈鹏越同学也参与了本文的工作。
长期开展活细胞蛋白质探究的昌增益课题组过去获得了以下代表性的发现:负责细菌新生外膜蛋白转运的超级蛋白质复合体的存在(Wang et al, JBC, 2016, 291:16720-16729);仅在休眠细菌中形成的可逆亚细胞结构复苏延迟体(由多种重要蛋白质通过发生相变而形成)的存在(Yu et al, Cell Discovery, 2019, 5:8; doi.org/10.1038/s41421-019-0080-3);细胞内合成能量货币ATP分子的ATP合酶以两种结构和功能形式存在(Liu et al, FEBS Journal, 2021, 288:2989-3009)等等。
本研究由国家自然科学基金(包括其原创探索基金项目)、北京大学生命科学学院-启东产业创新基金以及基因功能研究与操控全国重点实验室共同资助完成。研究过程中,北大蛋白功能光学显微成像平台、蛋白质组学核心设施、生命科学学院仪器中心及凤凰工程等多个校级科研平台为本工作提供了重要的技术支持。