检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
Wnt信号的胞内转运和分泌受到细胞极性的严格调控,尤其是在具有顶端-基底侧(apical-basolateral)极性的上皮细胞中。Wnt蛋白可以通过顶端或基底侧的细胞膜分泌,而这两种不同位置的分泌会影响其扩散范围和信号激活效果。例如,基底侧分泌的Wnt蛋白通常能够进行长距离扩散,激活远端细胞的信号传导;而顶端分泌的Wnt蛋白则倾向于进行短距离信号传递。因此,Wnt蛋白的极性转运对于维持信号传导的准确性尤为重要。
2024年10月14日,北京大学生命科学学院朱健教授/刘敏副研究员课题组在EMBO Reports杂志在线发表了题为Ehbp1 orchestrates orderly sorting of Wnt/Wingless to the basolateral and apical cell membranes的研究论文。该研究发现,膜运输调控蛋白Ehbp1在Wnt/Wingless(Wg)蛋白的极性转运中起到了关键作用,确保了Wnt/Wg蛋白在细胞顶端和基底侧膜之间的平衡分布。这一机制对于Wnt信号的准确传导具有重要意义。

在本研究中,研究团队首先通过果蝇的遗传筛选发现,Ehbp1突变体中Wnt/Wg的分泌出现异常,表现为Wnt/Wg蛋白在细胞内的异常积累。进一步研究表明,这一异常是由于Wnt货物受体Wntless(Wls)在细胞内基底侧膜的积累引起的(图1)。Wls无法有效运输Wnt/Wg蛋白至顶端膜进行分泌,进而影响了Wnt/Wg信号的正常传导。
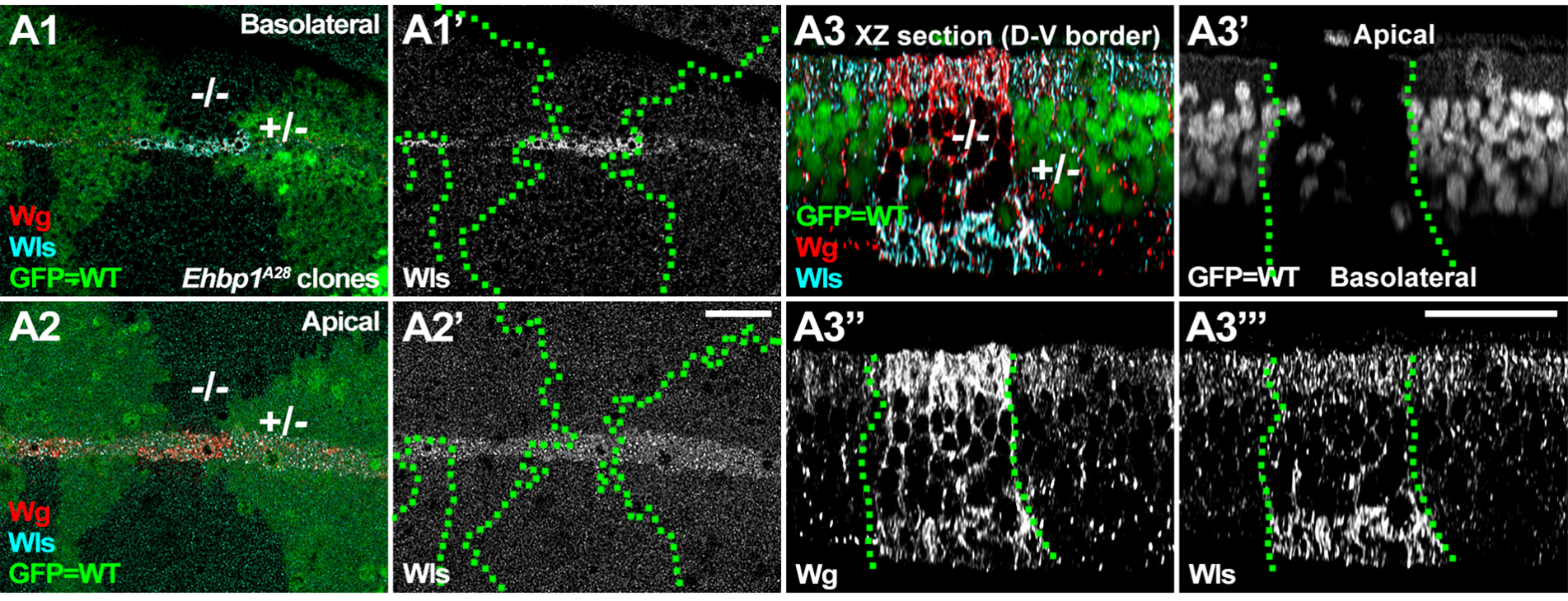
图1.Ehbp1突变体中Wls在基底侧膜的积累导致细胞内Wg的异常堆积。
生化分析表明,Ehbp1并不直接与Wls相互作用,而是通过适配蛋白复合物1(AP-1)来调控其功能。AP-1通常负责将Wnt/Wg-Wls囊泡运输至基底侧膜,而Ehbp1则会削弱AP-1与Wls之间的相互作用。具体而言,Ehbp1通过其Coiled-Coil基序与Wls竞争结合AP-1,干扰了AP-1对Wnt/Wg-Wls囊泡的运输,改变了囊泡的运输路径,从默认的基底侧膜转向顶端细胞膜(图2)。这种调控机制确保了Wnt/Wg蛋白在细胞膜上的极性分布,从而维持了信号传导的精确性。
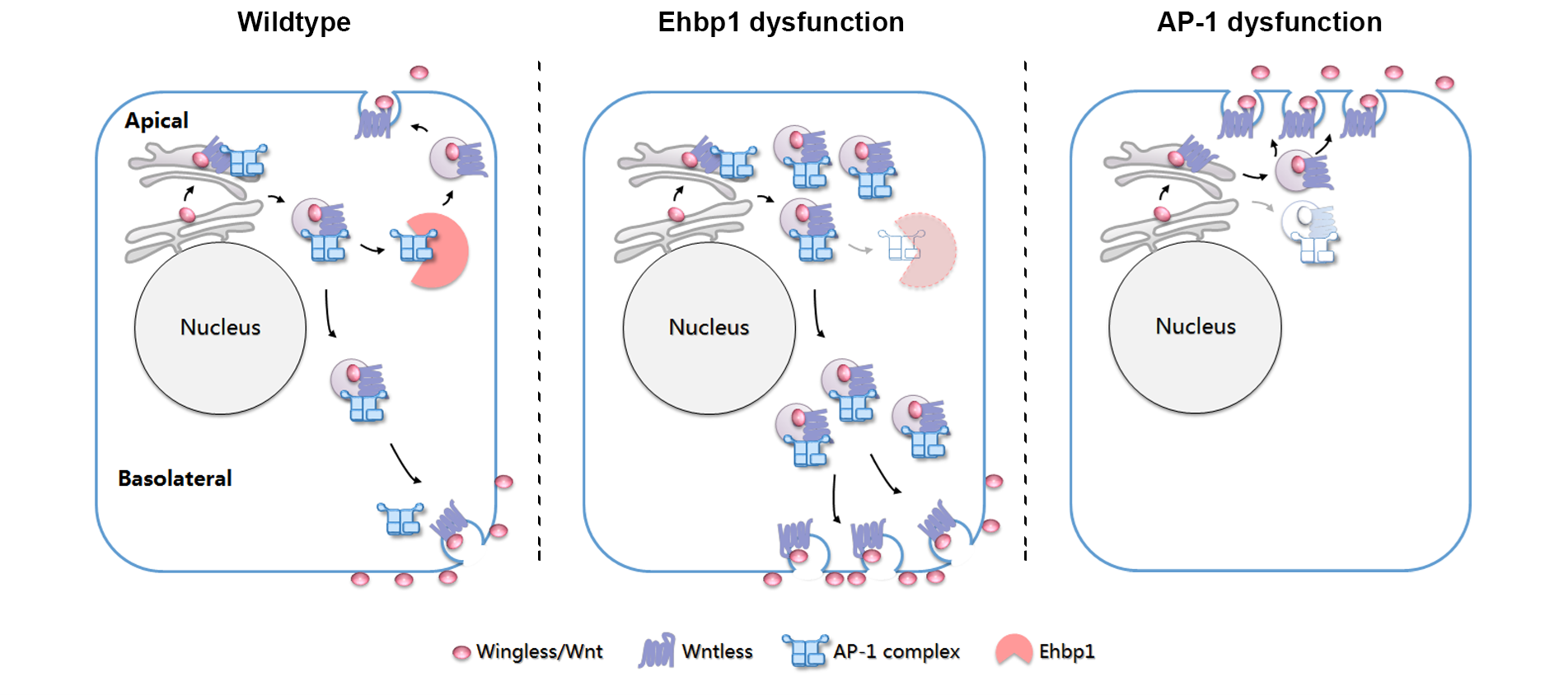
图2. Ehbp1、AP-1和Wls对Wnt/Wg极性转运的调控。
进一步的研究表明,Ehbp1对Wnt转运的调节在脊椎动物中是保守的。在具有顶端-基底侧极性的狗肾细胞(MDCK细胞)中,外源表达的WNT1和内源的WNT7A的极性转运均受到EHBP1的调控。这一发现提示了EHBP1对Wnt转运的调控机制在不同物种中的普遍性和重要性,为深入探索细胞内运输的调控机制提供了重要线索。
北京大学生命科学学院刘敏副研究员和朱健教授是该论文的共同通讯作者,北京大学生命科学学院已毕业博士研究生高远和科研助理冯婧是该论文的共同第一作者。北京大学生命科学学院已出站博雅博士后张延松、已毕业博士研究生易梦媛和博士后张乐冰对本研究有重要贡献。香港科技大学的阎言教授为该研究提供了重要帮助,北京大学生命科学学院公共仪器中心和凤凰工程蛋白质平台提供了技术支持。本研究得到了国家自然科学基金、国家重点研发计划、北京大学成都前沿交叉生物技术研究院、北京大学生命科学学院启东产业创新基金、北大-清华生命科学联合中心、细胞增殖与分化教育部重点实验室以及中国博士后科学基金的支持。
原文链接:https://www.embopress.org/doi/full/10.1038/s44319-024-00289-1