检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
代谢功能障碍相关脂肪性肝病(Metabolic dysfunction-associated steatotic liver disease,MASLD)是目前最常见的慢性肝病之一,影响了全球约三分之一的人口。该疾病谱广泛,涵盖了从单纯脂肪变性到代谢功能障碍相关脂肪性肝炎(Metabolic dysfunction-associated steatohepatitis,MASH)等多种病变。如果不及时干预,MASLD可能进一步进展为肝硬化、肝功能衰竭,甚至肝癌。然而,迄今为止针对MASLD的有效治疗手段仍然十分有限。
2024年8月24日,北京大学生命科学学院朱健/刘敏课题组在Journal of Lipid Research期刊上在线发表了题为Therapeutic siRNA targeting PLIN2 ameliorates steatosis, inflammation, and fibrosis in steatotic liver disease models的封面论文,确认了脂滴表面蛋白PLIN2是一个有前景的MASLD治疗靶点。研究团队开发了针对PLIN2的GalNAc-siRNA偶联药物,并在多种MASLD/MASH小鼠模型中验证了其显著疗效及良好的生物安全性。研究还揭示了该siRNA药物通过促进VLDL分泌发挥治疗作用的机制,并进一步利用人源化小鼠模型证明了其作为临床候选药物的潜力。这项研究为MASLD/MASH的治疗提供了一种新的可能性,提出了针对不同致病机制的患者群体的潜在治疗策略。
研究者的前期工作表明,Plin2蛋白是维持脂滴稳态的关键因子[1, 2]。基于这一发现,研究者首先设计了针对Plin2的siRNA以抑制其表达,并通过多种化学修饰增强siRNA药物的稳定性和延长其半衰期,同时优化其肝脏递送效率。随后,研究者在高脂饲料诱导的肥胖模型和ob/ob小鼠等多个MASLD模型中验证了siRNA药物的体内疗效,结果显示该siRNA药物在缓解肝脏脂肪变性、减轻肝脏损伤以及改善代谢能力方面均表现出良好的治疗效果(图1)。
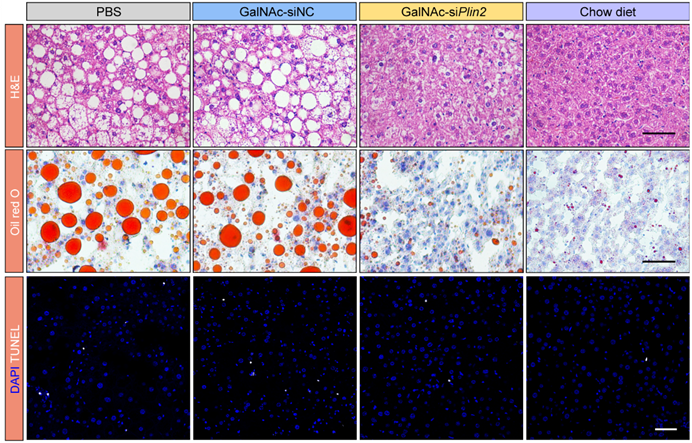
图1 GalNAc-siPlin2对高脂饲料诱导的MASLD小鼠模型的治疗效果
接下来,研究者探讨了该疗法的作用机制。在检测了多种影响肝脏脂肪代谢的因子后,发现该siRNA药物可能通过促进肝脏极低密度脂蛋白-甘油三酯(VLDL-TG)的分泌来发挥作用,并加速机体对分泌脂肪的代谢和产热过程(图2)。
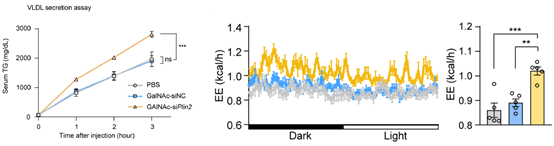
图2 GalNAc-siPlin2治疗增加肝脏VLDL-TG分泌并促进代谢产热
为了探究该疗法对MASLD炎症和纤维化进程的影响,研究者采用高脂高果糖饮食诱导的小鼠模型,并检验了该siRNA药物的治疗效果。数据显示,在野生型小鼠和人源化PLIN2敲入小鼠中,该核酸药物均能有效缓解脂肪变性、炎症和纤维化等多项指标,进一步证实了其作为MASLD治疗药物的潜力(图3)。
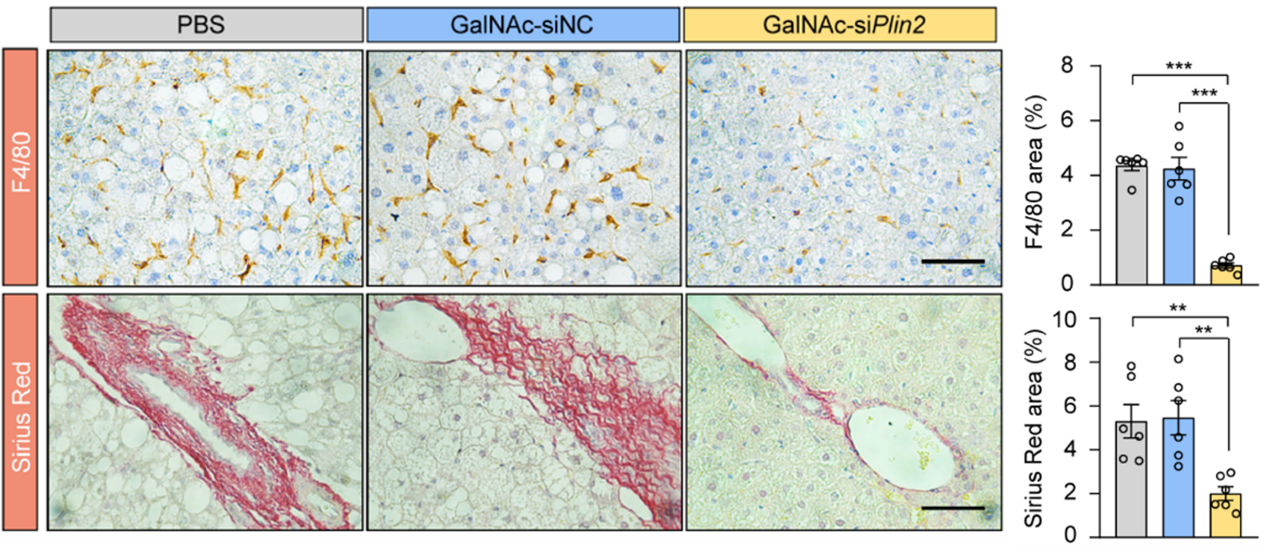
图3 GalNAc-siPlin2治疗改善高脂高果糖饮食诱导的MASH小鼠的炎症和纤维化
北京大学生命科学学院朱健教授、刘敏副研究员、已出站博雅博士后张延松博士是该论文的共同通讯作者,北京大学生命科学学院博士研究生王尧是该论文的第一作者,北京大学生命科学学院本科生周佳欣对本研究有重要贡献,北京大学邱义福课题组为该研究提供了技术支持,北京大学雷晓光教授、陈晓伟教授为该研究提供了建议和帮助,北京大学生命科学学院公共仪器中心和凤凰工程蛋白质平台提供了技术支持。本研究得到国家自然科学基金、国家重点研发计划、北京大学成都前沿交叉生物技术研究院、北大-清华生命科学联合中心、细胞增殖与分化教育部重点实验室以及中国博士后科学基金的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S0022227524001408
参考文献:
[1] Zhang, Y.*, Lin, S.*, Peng, J.*, Liang, X., Yang, Q., Bai, X., Li, Y., Li, J., Dong, W., Wang, Y., Huang, Y., Pei, Y., Guo, J., Zhao, W., Zhang, Z., Liu, M.# and Zhu, A. J.# (2022) Amelioration of hepatic steatosis by dietary essential amino acid-induced ubiquitination.Molecular Cell82: 1528-1542. doi: 10.1016/j.molcel.2022.01.021
[2] Zhao, W.*, Zhang, Y.*#, Lin, S., Li., Y., Zhu, A. J., Shi, H.# and Liu, M.# (2023) Identification of Ubr1 as an amino acid sensor of steatosis in liver and muscle.Journal of Cachexia, Sarcopenia and Muscle14: 1454–1467. doi: 10.1002/jcsm.13233