检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
DdCBE是一种新型的基因编辑工具,它能够实现线粒体基因组靶向位置 C·G → T·A 的碱基编辑,具有很大的临床应用潜力[1]。但在将该工具应用于临床治疗之前,需要系统和全面地评估其安全性。
2022年5月12日,北京大学生命科学学院伊成器课题组于 Nature在线发表了题为Mitochondrial base editor induces substantial nuclear off-target mutations 的研究论文。该研究详细评估了DdCBE在人类细胞系中的核基因组脱靶编辑效应,深入探究了其核基因组脱靶作用机制和工具的优化方案,并首次发现了由细菌毒素 DddA 构成的 DdCBE 碱基编辑工具与维持细胞三维基因组结构的关键因子 CTCF有相互作用。
该研究发现,DdCBE发挥线粒体基因组编辑功能的同时,一小部分意外地进入了细胞核,并在细胞核基因组中产生了广泛的脱靶编辑(图1)[2]。
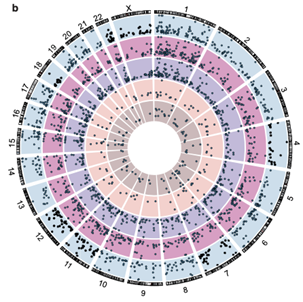
图1 DdCBE 能够产生广泛的核基因组脱靶编辑
该研究发现,DdCBE造成的核基因组脱靶编辑分为TAS依赖型脱靶编辑和TAS非依赖型脱靶编辑两种类型,且以后者居多。
其中,TAS依赖型脱靶和单端TALE序列特异性有关,这意味着在应用DdCBE工具时,需要分别对双侧 TALE 序列的基因组特异性进行考虑,从而减少这种脱靶的产生[2]。
而大量的TAS非依赖型脱靶不依赖于TALE序列特异性,并且在不同种类的DdCBEs 中共享[2]。该研究进一步发现这种脱靶编辑与CTCF蛋白有关,并且显著地富集在拓扑相关结构域(TAD)边界。这是一项意料之外的发现,并提示了DdCBE可能具有影响细胞核基因组三维结构的能力。
最后,该团队对DdCBE进行了优化改造,并且成功降低了其核基因组脱靶影响。
综上所述,本项研究利用课题组去年发表于《自然/方法》杂志的Detect-seq技术,对DdCBE碱基编辑工具在人类细胞中的核基因组脱靶编辑影响进行了无偏向性地评估。这项研究也是化学与生命科学交叉研究的成果,对于推动基因编辑技术在治疗线粒体疾病方面的应用提供了重要的理论依据。
北京大学生命科学学院、北京大学-清华大学生命科学联合中心、蛋白质与植物基因研究国家重点实验室伊成器教授为本文通讯作者;前沿交叉学科研究院雷芷芯博士,博士后孟浩巍、刘璐璐,清华大学生命科学学院博士生赵华男为本文共同第一作者;北京大学生命科学学院博士生饶希晨、前沿交叉学科研究院博士生闫永昌、乌浩、刘敏对本项目做出了重要贡献;北京大学分子医学研究所,北京大学-清华大学生命科学联合中心何爱彬研究员对本项目做出了重要的指导与帮助。另外,本研究也得到了北京大学生命科学学院魏文胜教授、杜鹏研究员、未来技术学院程和平教授、清华大学生命科学学院颉伟教授等多位专家教授的指导与帮助。该研究得到了国家重点研发计划、国家自然科学基金以及生命科学联合中心的资助。生命科学学院高性能计算平台为该研究提供了计算资源。感谢北京大学凤凰工程多个仪器平台对本项目的热心帮助!
原文链接:https://www.nature.com/articles/s41586-022-04836-5
参考文献:
1. Mok, B.Y., et al., A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature, 2020. 583(7817): p. 631-637.
2. Lei, Z., et al., Mitochondrial base editor induces substantial nuclear off-target mutations. Nature, 2022.