检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2024年1月17日,北京大学生命科学学院伊成器教授和细胞生态海河实验室王建伟副教授联合在Nature Aging上发表了题为Age-related noncanonical TRMT6–TRMT61A signaling impairs hematopoietic stem cells的研究论文,该研究揭示了m1A修饰催化酶TRMT6/TRMT61A通过非酶活依赖的功能,激活造血干细胞程序性坏死,进而驱动造血干细胞衰老的新机制,并且证明靶向抑制程序性坏死信号能够延缓造血干细胞衰老。

衰老相关疾病是老龄化时代人类需要应对的重大挑战,在快速更新的组织中,组织的衰老起始于干细胞的衰老。造血干细胞(HSC)能够生成所有血液细胞并保持自我更新能力。在衰老过程中,HSC功能衰退,表现为:数目增加,重建血液系统的能力减弱,同时呈现髓系分化倾向。HSC衰老是老年贫血、老年人适应性免疫下降以及老年人髓系白血病高发的重要原因[1],因此解析HSC衰老的分子机制对于深入理解血液系统衰老至关重要。m1A是一种发生在mRNA和tRNA腺苷第一位氮原子上的甲基化修饰,TRMT6/61A复合物是主要的m1A催化酶, TRMT6/61A及其介导的m1A修饰在多种生物学体系中起着重要功能[2,3],然而m1A修饰是否参与调控HSC衰老过程仍然有待探究。
该研究首先发现TRMT6/61A主要在造血干细胞和祖细胞中表达,且在衰老的HSC中表达上调。利用慢病毒介导的过表达和转基因小鼠模型,证实衰老上调的TRMT6/61A是HSC功能衰退的驱动因素,但是通过tRNA-m1A-seq发现衰老前后的m1A修饰水平没有发生变化。其后,研究者又进一步深入探究了衰老过程中TRMT6/61A损伤HSC功能的分子机制,通过tRF-seq技术发现并证实TRMT6/61A介导tRNA片段3’-tiRNA-Leu-CAG在衰老前后显著变化,并且这种变化不依赖于其m1A甲基转移酶功能,而是依赖于TRMT6/61A与tRNA切割蛋白ANG的结合,促进3’-tiRNA-Leu-CAG的生成。研究者基于转录组分析和生物化学实验证实TRMT6/61A-3’-tiRNA-Leu-CAG通过激活程序性坏死损伤HSC功能,更为重要的是程序性坏死信号在衰老HSC中激活,且靶向抑制程序性坏死能够提升HSC功能。最后,该研究证实TRMT6/61A本底甲基转移酶活性对于HSC维持不可或缺,并通过生化实验揭示了CRL4DCAF1泛素降解途径在衰老HSC中失活是TRMT6/61A蛋白累积的原因。
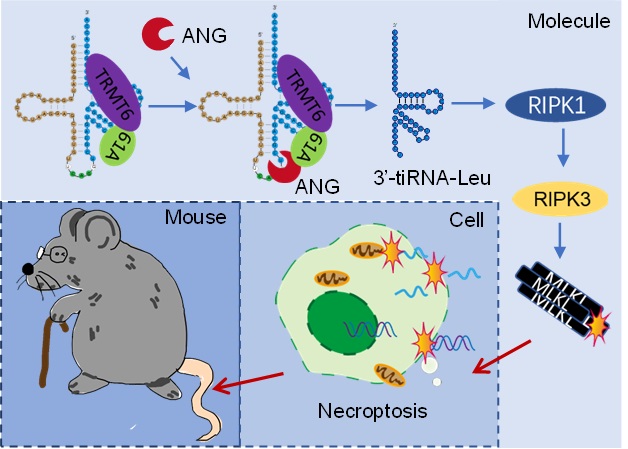
图1. TRMT6/61A的非酶活功能调控tiRNA产生,介导造血干细胞衰老示意图。
综上,该研究工作从分子→细胞→动物模型三个层次系统阐述了TRMT6/61A在HSC衰老调控中的功能,并发现了TRMT6/61A的非酶活新功能,首次建立tRNA代谢与促炎性细胞死亡之间的联系,并为靶向干预造血系统衰老提供了程序性坏死这一相对安全的药物靶标。
清华大学何汉卿博士、王毓倩博士、北京大学博士研究生张晓婷和李笑雨博士(现浙江大学医学院研究员)为本论文的共同第一作者,细胞生态海河实验室王建伟副教授、北京大学生命科学学院伊成器教授为该文的共同通讯作者。
原文链接:https://www.nature.com/articles/s43587-023-00556-1
参考文献:
1 Abelson, S. et al. Prediction of acute myeloid leukaemia risk in healthy individuals. Nature 559, 400-404 (2018).
2 Li, X. et al. Base-Resolution Mapping Reveals Distinct m(1)A Methylome in Nuclear- and Mitochondrial-Encoded Transcripts. Mol Cell 68, 993-1005 e1009 (2017).
3 Liu, Y. et al. tRNA-m1A modification promotes T cell expansion via efficient MYC protein synthesis. Nat Immunol 23, 1433-1444 (2022).