检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
神经细胞经特殊的连接点——突触连接起来所组成的神经环路是神经系统(脑)的基本功能单元,其通过释放某种化学物质(神经递质)实现细胞间的信号传递。不同的神经细胞释放不同的递质,从而行使不同的功能。视觉作为机体最重要的感觉之一,其主要功能是分辨图像(图像视觉),其它功能(非图像视觉)则与图像生成并无直接关联,而起着重要的辅助作用(如对昼夜节律的调节等)。尽管研究者们很早就认识到,视觉系统的这两种功能分别通过两类感光细胞来实现:一类解析局部反差,另一种解析整体光亮度1,2;同时近年的研究表明,产生局部反差的感光细胞也能传递整体光亮度3,4,但其神经机制尚不清楚。2023年10月25日,北京大学生命科学学院、麦戈文脑科学研究所、定量生物学中心、生命科学联合中心罗冬根团队在Nature发表题为“A single photoreceptor splits perception and entrainment by cotransmission”的研究论文,报道了果蝇同一感光细胞同时释放两种递质分离两种不同视觉功能的神经机制。
虽然果蝇复眼不同于脊椎动物的眼,但它们有着非常保守的视觉功能和机制5。得益于其丰富的可用于标记和操纵视觉通路的遗传工具,果蝇成为当前视觉研究的一种重要模式动物。在上述研究中,罗冬根团队应用国际领先的果蝇大脑神经元的单电极及多电极膜片钳电生理记录技术,揭秘了复眼调节生物节律的神经机制。研究发现果蝇复眼的一种感光细胞同时释放组胺和乙酰胆碱作为神经递质,其中组胺介导精细的运动视觉,而乙酰胆碱则通过作用于该团队新发现的“巨无霸”伞形神经元(按其形态特征aMe-innervating, multicolumnar, and arcuate shape命名为AMA神经元)来调节昼夜节律。每个AMA神经元的树突像巨伞一样延伸覆盖了整个视觉脑区,且不同AMA间通过突触连接在一起,从而整合大视野光亮度信息。这些是实现非图像视觉功能所需的理想特性。此外,组胺和乙酰胆碱间还存在相互调控。这些重要的发现提示,果蝇视觉信号的分离源于视觉信号发生的最初阶段(光感受细胞以一个细胞释放两种递质),是一种新的视觉信号传递模式(图1)。
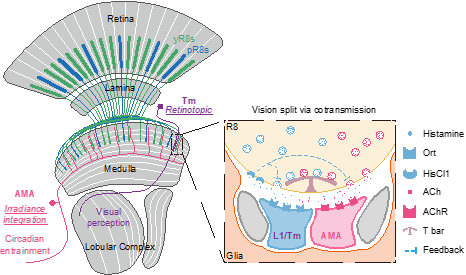
图1:R8感光细胞分离图像和非图像视觉的神经机制
在哺乳动物中,有些视觉信号的分离用“一递质,两受体”方式,即使用一种递质和有相反电信号的两种受体。该工作揭示了在某递质(如果蝇的组胺)无相反电信号受体的条件下,感光细胞高效分离视觉信号的策略,极大促进了领域内对视觉形成和生物节律的理解。值得注意的是,哺乳动物很多脑区也有“一细胞,两递质”现象,但其生理功能却还鲜为人知,所以该工作还为“一细胞,两递质”的研究提供了新的范式和思路。
此外,该研究中发现的AMA神经元和该团队最近报导的xCEO(extra-Clock Electrical Oscillator,生物钟外的振荡神经元)属于同一类神经元,说明这类巨伞形振荡神经元不仅能在光暗变化时实现内源节律与外部时间相同步6,还能在恒定黑暗条件下维持昼夜节律7,由此可知其对昼夜节律调控有着至关重要的作用。
罗冬根研究员为该论文通讯作者;晓娜博士(2016级前沿交叉学科研究院博士生)、徐爽(2020级生科院博士生)、李泽楷(2022级生科院博士生)为该文共同第一作者;前实验室成员唐敏博士(Southwestern University)和李梦彤博士(Columbia University)、杨甜(2018级生科院博士生)、马思行(2020级生科院博士生)、王鹏浩(2019级生科院博士生)、毛仁波博士(北京脑科学与类脑研究所)、Ajay Sunilkumar(Université Paris-Saclay)、François Rouyer教授(Université Paris-Saclay)和曹丽慧教授(首都医科大学)为本文做出重要贡献。该研究获国家自然基金委、科技部科技创新2030(脑计划)、膜生物学国家重点实验室、生命科学联合中心和北京脑科学与类脑研究所支持。
罗冬根实验室近年来在昼夜节律和感觉编码方面取得了一系列重要的原创性结果。实验室目前在这两方向利用果蝇和小鼠结合分子生物学、动物行为和神经电生理等方法进行深入研究,诚招相关专业的特聘研究员、博士后和研究助理。欢迎有扎实分子生物学、或神经环路、或神经电生理和成像、或动物行为研究背景者应聘,简历请投递至:dgluo@pku.edu.cn
原文链接:https://doi.org/10.1038/s41586-023-06681-6
参考文献:
1. Sanes, J.R. & Zipursky, S.L. Design principles of insect and vertebrate visual systems. Neuron 66, 15-36 (2010).
2. Lazzerini Ospri, L., Prusky, G., & Hattar, S. Mood, the circadian system, and melanopsin retinal ganglion cells. Annu. Rev. Neurosci. 40, 539-556 (2017).
3. Saint-Charles, A. et al. Four of the six Drosophila rhodopsin-expressing photoreceptors can mediate circadian entrainment in low light. J. Comp. Neurol. 524, 2828-2844 (2016).
4. Güler, A.D. et al. Melanopsin cells are the principal conduits for rod-cone input to non-image-forming vision. Nature 453, 102-105 (2008).
5. Sanes, J.R. & Zipursky, S.L. Design principles of insect and vertebrate visual systems. Neuron 66, 15-36 (2010).
6. Xiao, N. et al. A single photoreceptor splits perception and entrainment by cotransmission. Nature 622, (2023).
7. Tang, M. et al. An extra-clock ultradian brain oscillator sustains circadian timekeeping. Science advances 8, eabo5506 (2022).