检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
叶酸(维生素B9)作为一碳转移反应的辅酶,参与嘌呤和胸苷酸合成、丝氨酸和蛋氨酸代谢以及核酸和蛋白质的甲基化修饰等生理进程。叶酸代谢异常会引起严重的发育缺陷和多种疾病,包括癌症和神经系统疾病等。哺乳动物缺乏自主合成叶酸的能力,因此,必须依赖特定的转运或受体蛋白从胞外摄取叶酸。还原性叶酸转运蛋白SLC19A1(或RFC)在多种细胞类型中广泛表达,是人体大部分组织器官摄取叶酸的主要途径。此外,抗叶酸药物,如甲氨蝶玲(methotrexate)等,被广泛应用于多种肿瘤和自身免疫性疾病的治疗。作为叶酸类似物,这些药物也主要依赖SLC19A1蛋白被转运进入细胞内从而发挥功能。
北京大学生命科学学院和生命科学联合中心张哲课题组于2022年12月28日在Cell Discovery杂志发表了题为“Molecular mechanism of substrate recognition by folate transporter SLC19A1”的研究论文。本工作报道了人源SLC19A1蛋白分别与两种底物5-甲基四氢叶酸(5-MTHF)和硫胺素焦磷酸(TPP)结合的冷冻电镜结构。结合生化和细胞实验,作者阐明了SLC19A1蛋白底物识别的分子机制,并证实了TPP是SLC19A1蛋白转运叶酸的反向偶联底物。同时,本研究还为抗叶酸药物的优化和改造提供了重要的理论基础。
人源SLC19A1蛋白的分子量仅65kDa,主要由12条跨膜螺旋(TM)组成,这为采用冷冻电镜技术直接解析其高分辨率结构带来了巨大的挑战。为了解决这一难题,作者巧妙组装了BRIL-SLC19A1/Fab/Nb三元复合物,并成功解析了该复合物分辨率为3.6 Å的冷冻电镜结构。该结构中,SLC19A1蛋白采用经典的MFS超家族折叠模式,并呈现inward-facing构象。利用同样的策略,作者进一步解析了SLC19A1蛋白与最适还原性叶酸底物5-MTHF的复合物结构。通过对5-MTHF结合位点的突变分析,作者鉴定出SLC19A1蛋白中的Glu123、Arg133、Tyr281和Arg373四个氨基酸残基对于5-MTHF 的识别和转运至关重要。另外,通过进一步的结构分析和功能验证,作者还揭示了SLC19亚家族中另外两个同源性极高的家族成员SLC19A2和SLC19A3不识别叶酸的分子机制。
SLC19A1作为一个反向转运蛋白,转运叶酸需要与另外一个底物的反向转运相偶联,然而,该底物的具体身份领域内还存在争议。根据此前的报道,作者对多种潜在的有机磷酸盐底物进行了测试,包括ATP和NAD+等。竞争性转运抑制实验、热稳定性实验以及MST实验结果共同表明,TPP最可能是在生理条件下被SLC19A1蛋白用于偶联叶酸转运的底物。于是,作者进一步解析了SLC19A1蛋白与TPP的复合物结构,发现TPP与5-MTHF的结合位点和方式几乎一致。
根据以上实验结果,作者最终提出了SLC19A1蛋白利用alternating access机制反向转运5-MTHF和TPP的模型(图1)。细胞内高浓度的TPP结合SLC19A1蛋白后诱导其从inward-facing构象转变为outward-facing构象,在该构象下TPP被释放到细胞外,而5-MTHF则结合到相同的位点,并诱导相反的构象变化;当SLC19A1蛋白重新变回inward-facing构象后,5-MTHF则被释放,TPP重新结合,由此完成一个转运循环。在该过程中,SLC19A1蛋白利用顺电化学梯度向胞外转运TPP所提供的能量实现对5-MTHF向胞内的逆电化学梯度转运。
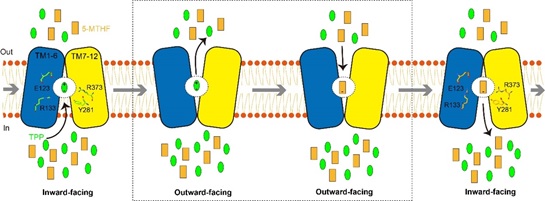
图1. SLC19A1蛋白反向转运5-MTHF和TPP的模型。
北京大学生命科学学院张哲研究员为本文通讯作者,北京大学前沿交叉学科研究院2019级PTN项目博士生党瑜为本文第一作者。另外,北京大学前沿交叉学科研究院2020级博士生周栋、课题组前技术员杜晓娟、北京大学生命科学学院杨竞教授、美国圣裘德儿童研究医院Hongtu Zhao博士和Chia-Hsueh Lee研究员、北京大学生命科学学院2019级本科生王祎洁以及北京大学生命科学学院冷冻电镜平台秦昌东博士和郭振玺博士对本文做出重要贡献。本研究得到国家重点研发计划重点专项、国家自然科学基金面上项目、生命科学联合中心、膜生物学国家重点实验室、北京大学生命科学学院启东产业创新基金以及李革-赵宁生命科学青年研究基金的资助;并依托北京大学冷冻电镜平台和生命科学学院公共仪器中心凤凰工程蛋白质平台的技术支持。